|
Unterrichtseinheit
Reaktionen und Teilchenmodell
|
Aktivierungsenergie
Energie, die aufgewendet werden muss, um eine chemische Reaktion in Gang zu bringen.
exotherme Reaktion
Chemische Reaktion, bei der innere Energie frei wird.
Die Edukte sind energiereicher als die Produkte.
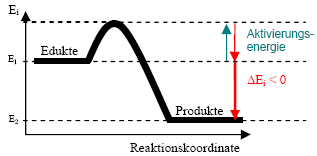
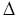 H < 0 (also negativ) H < 0 (also negativ)
endotherme Reaktion
Chemische Reaktion, bei der Energie aus der Umgebung aufgenommen und in innere Energie umgewandelt wird. Die Produkte sind energiereicher als die Edukte.
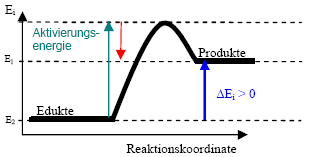
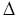 H > 0 (also positiv) H > 0 (also positiv)
stöchiometrische Wertigkeit
Unter stöchiometrischer Wertigkeit eines Elements versteht man die Anzahl der Wasserstoffatome, die ein Atom des betreffenden Elements binden oder ersetzten kann.
z.B. O²¯ ist 2-wertig in H2O
Ausnahme: O ist 1-wertig in H2O2 (Wasserstoffperoxid)
Analyse
Chemische Reaktion bei der eine chemische Verbindung in zwei oder mehrere Produkte zerlegt wird (Verbindungen oder Elemente). z.B. 2H2O -> 2H2 + O2
Synthese
Chemische Reaktion, bei der aus zwei oder mehr Edukten ein Produkt entsteht.
z.B. Fe + S -> FeS
Umsetzung
Chemische Reaktion, bei der Analyse und Synthese miteinander verknüpft sind.
z.B. Na + 2H2O -> 2NaOH + H2
Katalysator
Stoffe, die die Reaktionsgeschwindigkeit durch herabsetzen der Aktivierungsenergie erhöhen. Sie werden nicht verbraucht und liegen am Ende der Reaktion unverändert vor.
relative Atom- und Molekülmasse
Bezugspunkt für die relativen Atommassen ist der Kohlenstoff ¹²C.
Seine relative Atommasse (1/12 der Masse eines Kohlenstoffatoms) ist die atomare Masseneinheit u (atomic mass unit). 1u = 1/12mA (¹²C) |