|
Unterrichtseinheit
Atombau
|
Kern-Hülle-Modell
Bausteine der Atome: Proton, Neutron, Elektron
Radioaktivität
- Radioaktivität als Folge des Atomzerfalls.
- Rückblick auf die historische Entwicklung der Atomvorstellung (Demokrit, Dalton).
- Anknüpfung an Ionentheorie: Atome sind aus noch kleineren Teilchen zusammengesetzt.
- Wie kann der Aufbau der Atome erforscht werden? Prinzipiell zwei Möglichkeiten: Kernstrahlung, Beschuss.
Entdeckungsgeschichte der Radioaktivität
1896 Entdeckung der Röntgenstahlen
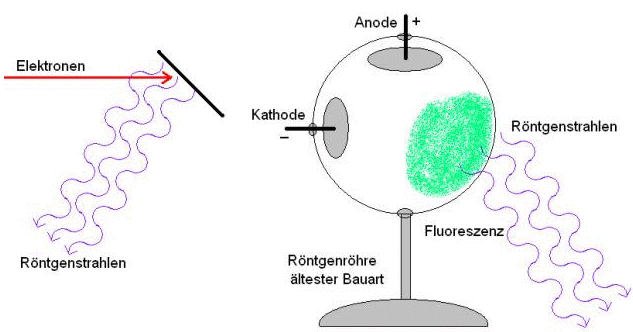
1896 Becquerels Entdeckung der Radioaktivität

Becquerels Hypothese
Wenn die Röntgenstrahlen eine Begleiterscheinung der Fluoreszenz wären, dann sollte auch ein fluoreszierendes Uransalz bei Belichtung mit UV-reichem Sonnenlicht Röntgenstrahlen aussenden, die eine darunter liegende Fotoplatte schwärzen müssten.
Entdeckung des Radiums.
Leuchtzifferblatt (Radium + Zinksulfid).
Spuren von a-Strahlen des Radiums in der Nebelkammer.
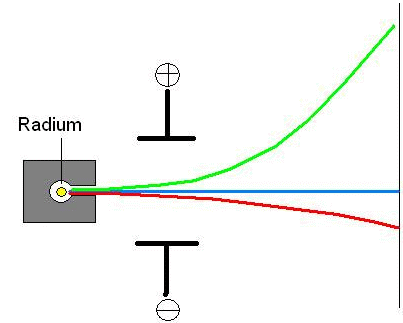
Komponenten der radioaktiven Strahlung und ihre Eigenschaften:
|
Ablenkung von radioaktiven
Strahlen im elektrischen Feld liefert.
3 Komponenten:
b-Strahlen
Masse = 1/2000 u
Ladung = - e
Elektronen
g-Strahlen
Masse = 0
Ladung = 0
Elektromagnet. Wellen
a-Strahlen
Masse = 4 u
Ladung = + 2 e
Heliumkerne |
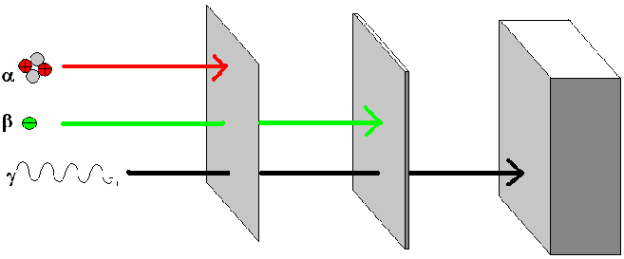
Reichweite und Abschirmung der radioaktiven Strahlung
|
Reichweite in Luft |
Abschirmung durch |
| a |
einige cm |
Blatt Papier |
| b |
einige Meter |
Taschentuch |
| g |
Abnahme nach Abstandsquadratgesetz |
Beton und Bleiwände |
Rutherfords Streuversuch - Kern-Hülle-Modell
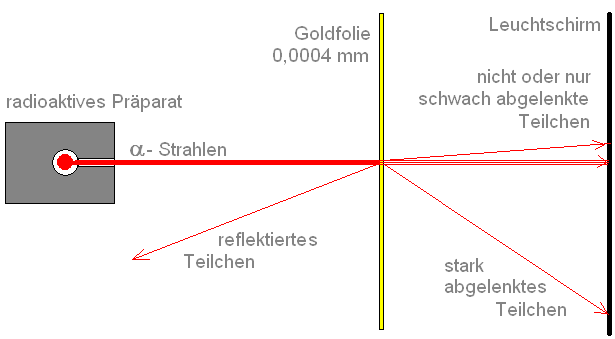
Beobachtung
Fast alle a-Teilchen durchdrangen die Folie, ohne abgelenkt zu werden. Nur eines von etwa 100000 Teilchen wurde abgelenkt.
Ergebnis Atommodell von Rutherford
Die gesamte positive Atomladung und nahezu die gesamte Atommasse sind auf einen kleinen Bereich von der Größenordnung 10-14 m im Mittelpunkt des Atoms konzentriert. Dies ist der Atomkern. Hiernach beträgt der Kerndurchmesser nur rund 1/10 000 des Atomdurchmessers. Das bedeutet aber, dass der überwiegende Teil des Atoms ein leerer Raum ist.
Da das Atom nach außen hin elektrisch neutral ist, muss die positive Kernladung durch eine entsprechende Anzahl von Elektronen kompensiert werden. Diese Elektronen werden durch die Coulomb-Kräfte von dem positiv geladenem Kern angezogen und im Atomverband festgehalten. Damit sie nicht in den Kern hineinstürzen, muss angenommen werden, dass sie sich, ähnlich wie die Planeten um die Sonne, um den Kern bewegen. Die Gesamtheit dieser Elektronen bildet die Atomhülle.
|
Das Atom besteht aus einem Atomkern und einer Atomhülle.
Der Atomkern enthält nahezu die gesamte Masse des Atoms und ist positiv geladen.
Die Atomhülle enthält die der positiven Kernladung entsprechende negative Ladung in Form von Elektronen. |
Veranschaulichung der Größenverhältnisse Atomkern zu Hülle: Erbse im Kölner Dom;).
Atomkern und Elementarteilchen, Isotope
Bausteine des Atoms
Kern: Protonen und Neutronen (=Nukleonen)
Hülle: Elektronen
|
|
Elektron |
Proton |
Neutron |
|
Ladung |
-e |
+e |
0 |
|
Masse |
1/2000u |
1,0073u |
1,0087u |
Bau einfacher Atome
Schreibweise der Nuklide
Nukleonenzahl
Elementsymbol
Prozentzahl |
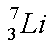 |
Ein chemisches Element ist eine Substanz, deren Atome in ihrer Protonenzahl (=Kernladungszahl) übereinstimmen.
Isotope
Frage
Ungeradzahligkeit vieler Atommassen im Periodensystem! Ursache?
Isotope sind Atome eines Elements, die sich in der Zahl der Neutronen und damit in ihrer Atommasse unterscheiden.
Beispiele
Atomhülle und Periodensystem
Entdeckung des Periodensystems (Mendelejew, Lothar Meyer, 1869).
Ordnet man die Elemente nach steigender Ordnungszahl (=Protonenzahl, Kernladungszahl) und stellt Elemente mit ähnlichen Eigenschaften untereinander, so erhält man das Periodensystem der Elemente.
Das Periodensystem spiegelt die Elektronenverteilung (= Elektronenkonfiguration)
der Atome der verschiedenen Elemente wider. Mit jeder Periode beginnt die Besetzung einer neuen Schale. Die Elemente einer Gruppe besitzen gleichviele Valenzelektronen.
Elektronenkonfiguration und Reaktionsverhalten
Versuch
Nachweis der Halogenidionen mit Silbernitratlösung
Kaliumchlorid-, Kaliumbromid- und Kaliumiodidlösung mit 3 Tr. verd. Salpetersäure ansäuern, mit 10 Tr. 0,5 ml Silbernitratlösung versetzen.
Prüfung der Löslichkeit der Niederschläge in verd. Ammoniak (bzw. konz. Ammoniak als Lehrerversuch).
Ergebnis
|
+Silbernitratlösung
|
Kalium-chlorid
Käsigweißer
Niederschlag von
Silberchlorid AgCl
löslich in verd. Ammoniak |
Kalium-bromid
gelblicher
Niederschlag von Silberbromid AgBr
unlöslich in verd. Ammoniak
löslich in konz. Ammoniak |
Kalium-iodid
gelber
Niederschlag von Silberiodid AgI
unlöslich in
verd. und konz. Ammoniak |
KCl + AgNO3 —› AgCl + KNO3
Silberchlorid (weiß)
KBr + AgNO3 —› AgBr + KNO3
Silberbromid (gelblich)
KI + AgNO3 —› AgI + KNO3
Silberiodid (gelb)
Hinweis auf Lichtempfindlichkeit der Silberhalogenide und Bedeutung für die Fotografie.
Versuch
Salzbildung der Halogene mit Metallen
Chlorwasser, Bromwasser und Iodlösung werden mit Magnesium- bzw. Zinkpulver geschüttelt.
Ergebnis
Verschwinden der Halogenfarbe und des Halogengeruchs - mit Silbernitratlösung lassen sich Halogenidionen nachweisen.
2 e + Cl2 —› 2 Cl + Cl2 —› 2 Cl 
Zn —› Zn2+ 2 e
——————————————
Zn + Cl2 -> Zn2+ + 2 Cl
Zn + Cl2 -> ZnCl2
Versuch
Unterscheidung von Brom und Iod durch Ausschütteln mit Benzin.
Ergebnis
Brom löst sich in Benzin mit brauner, Iod mit violetter Farbe.
Wichtige Begriffe zur Unterrichtseinheit
Isotope
Atome des gleichen Elements, die sich in ihrer Neutronenzahl und damit in ihrer Masse unterscheiden, nennt man Isotope.
Beispiel: 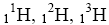
Atomaufbau
Atome sind aus Elementarteilchen aufgebaut: positiv geladene Protonen und elektrisch neutrale Neutronen bilden den Atomkern und bestimmen die Masse des Atoms, negativ geladene Elektronen bilden die Atomhülle.
Aufbau der Atomhülle
Elektronen besetzen in der Atomhülle fest umschriebene Energiezustände,
die Elektronenschalen.
Für die größtmögliche Anzahl an Elektronen in einer Schale gilt: 2n² (n = Schalennummer)
Valenzelektronen
Anzahl der Außenelektronen; sie bestimmen die chemische Eigenschaften eines Elements.
Ionisierungsenergie
Ionisierungsenergie ist die Energie, die zugeführt werden muss, um aus einem Atom oder einem Ion ein Elektron zu entfernen. In einer Periode nimmt sie von links nach rechts und in einer Hauptgruppe von unten nach oben zu.
Oktettregel
Die Erscheinung, dass die Atome in Verbindungen häufig eine stabile edelgasähnliche Elektronenkonfiguration besitzen, nennt man "Edelgasregel" oder "Oktettregel". |