|
Unterrichtseinheit
Säure / Base
|
pH-Wert
pH = –lg c(H3O ) )
z.B. c(H3O ) = 0,001 mol/l = 10¯³ mol/l –› pH = 3 ) = 0,001 mol/l = 10¯³ mol/l –› pH = 3
und c(OH¯) = 10¯¹¹ mol/l (11 resultiert aus 14 - 3)
Brönsted-Säure
Protonendonator
Brönsted-Base
Protonenakzeptor
Protolyse
Protonenübergang (= Säure-Base-Reaktion)
Ampholyt
Teilchen, die sowohl Protonen aufnehmen als auch abgeben, nennt man Ampholyte:
H2O —› OH¯+ H
H2O + H —› H3O —› H3O
Äquivalenzpunkt
Der Punkt, an dem sich äquivalente (= gleiche) Mengen Säuren und Basen umgesetzt haben.
Maßanalyse (= Neutralisationstitration)
Die Konzentration einer unbekannten sauren oder alkalischen Lösung (Probelösung) kann durch Zugabe einer basischen oder sauren Lösung bekannter Konzentration (= Maßlösung) gerade bis zur Neutralisation (Neutralpunkt) ermittel werden.
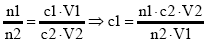
|